
大约八分之一的男性将在他们的一生中被诊断出患有前列腺癌。受年龄、种族/民族和其他变量等因素的影响,个体患前列腺癌的风险因人而异。
最近的研究已经确定雌激素代谢是前列腺癌的一个潜在危险因素。评估激素代谢和酶的活性提供了一个全面了解患者健康的方法。
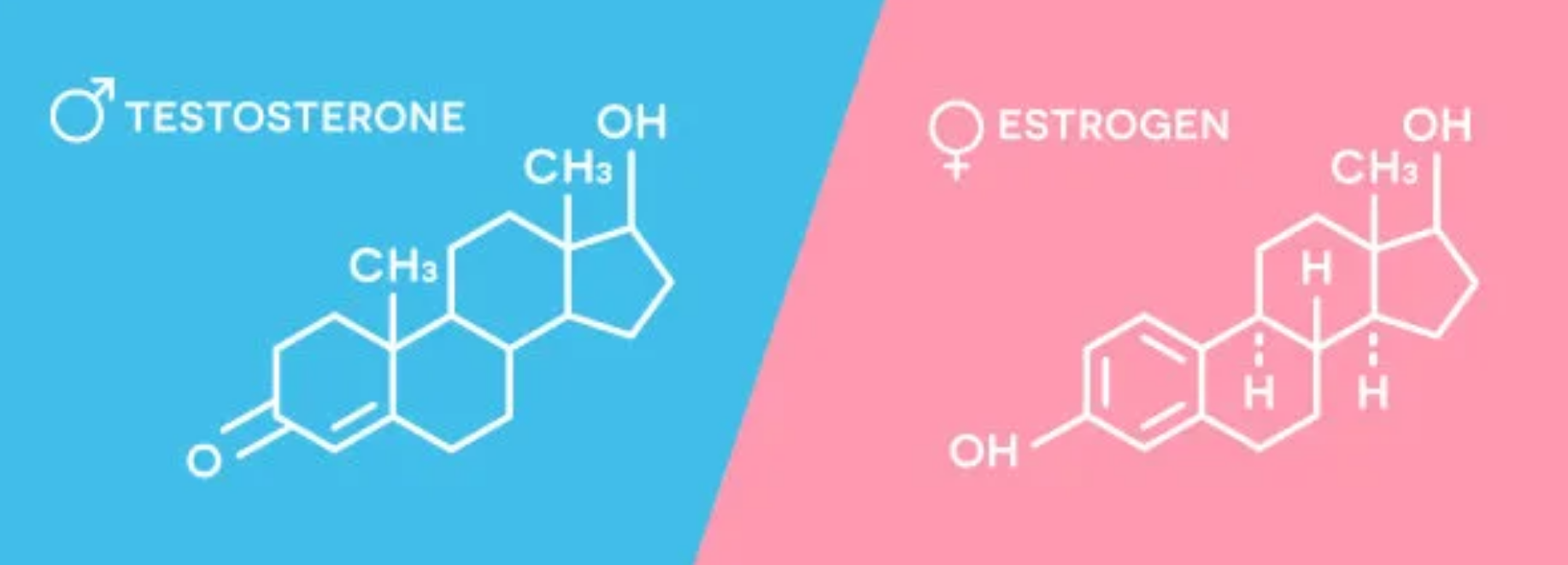
与指纹相似,每个个体的激素代谢都是不同的。雌激素代谢主要发生在肝脏,涉及一个从细胞色素P450酶家族介导的I期羟基化开始的两步过程。CYP1A1基因调节肝脏内的这种代谢活动,而CYP1B1基因负责外周组织中的雌激素代谢,包括前列腺、乳房、卵巢和子宫。I阶段羟基化产生三种具有显著不同生物活性的雌激素代谢物:2-羟乙酮/雌二醇(2-OH,由CYPAl酶)、16-羟乙醇/雌二醇(16-0H,CYP3A4酶催化)和4-羟乙醇/雌二醇(4-0H,CYPB1酶催化)。2-0H代谢物被认为是“有益的”雌激素,因为它们是较弱的和潜在的危害较小的雌激素活性。相比之下,16-0H和4-0H代谢物表现出持久的雌激素活性,如果不受调控,这可能会促进有害的组织生长。值得注意的是,主要通过4-0H途径代谢雌激素的个体可能有患前列腺癌的风险显著增加。CYP1B1酶,作为4-OH代谢的驱动因子,普遍存在于激素反应性组织中,包括前列腺、乳腺、卵巢和子宫内膜。与健康组织相比,在肿瘤组织中也发现了大量的水平,特别是在雌激素介导的疾病中观察到的高水平,这也可能导致前列腺癌。
在Carnell及其同事进行的一项研究中,在正常前列腺组织中未检测到CYP1B1活性。然而,CYP1B1在前列腺癌中过表达,并且在相关的癌前组织和良性增生组织中也可检测到,提示其可能与恶性进展有关,并提示CYP1B1是一个潜在的干预靶点。其他研究甚至表明,CYP1B1高表达的前列腺癌患者的生存率较低。如果检测显示出对4-OH代谢的偏好,则需要考虑两种干预方法:支持更少的CYP1B1通路的移动,支持更多的CYP1A1通路的移动,以及通过COMT酶支持II期代谢,使这些反应性4-OH代谢物减少危险。
研究发现,这些天然产物可以促进CYP1A1的生长:

第一阶段的代谢本身可以产生自由基。
因此,需要考虑以下抗氧化剂来进一步减少对组织的额外伤害:
维生素A、C、E
硒
铜
锌
锰
CoQ10
α-硫辛酸
硫醇(大蒜、洋葱、十字花科蔬菜)
生物黄酮类
水飞蓟素
低聚原花青素
谷胱甘肽
褪黑素

第二阶段代谢涉及到第一阶段代谢物的甲基化成更多的水溶性物质,可以通过COMT酶排出体外,理想情况下会变得不活跃。这是一个极其重要的一步。如果4-OH代谢物没有失活,它们就有可能形成醌类和或半醌类,它们具有高度致癌性和基因毒性,能够诱导和增强前列腺癌。为了降低这种风险,优化COMT的功能是至关重要的。以下内容已被证明可以增加COMT活性:

对于那些COMT活性较低,醌活性潜力更大的人,两种补充剂可能提供一些额外的保护:
儿茶酚雌激素能减少半醌还原为儿茶酚雌激素能诱导雌激素保护酶醌还原酶调节CYP1B1,从而降低其活性并最大限度地减少4-OH代谢物形成的潜力。
能将雌激素半醌类还原为儿茶酚雌激素
主要作用是与醌类反应形成缀合物,阻止雌激素-DNA加合物的形成
https://www.cancer.org/cancer/types/prostate-cancer/about/key-statistics.html. Accessibility verified 5/17/2024. Carnell DM, Smith RE, Daley FM, Barber PR, Hoskin PJ, Wilson GD, Murray GI, EverettSA. Target validation of cytochrome P450 CYP1B1 in prostate carcinoma withprotein expression in associated hyperplastic and premalignant tissue. Int J RadiatOncol Biol Phys. 2004 Feb 1;58(2):500-9. doi: 10.1016/j.ijrobp.2003.09.064. PMID:14751521. Cavalieri E, Rogan E. The 3,4-quinones of estrone and estradiol are the initiators ofcancer whereas resveratrol and N-acetylcysteine are the preventers. InternationalJournal of Molecular Sciences. 2021;22(15):8238. doi:10.3390/ijms22158238Gajjar K, Martin-Hirsch PL, Martin FL. CYP1B1 and hormone-induced cancer. CancerLett. 2012 Nov 1;324(1):13-30. doi: 10.1016/j.canlet.2012.04.021. Epub 2012 May 2. PMID: 22561558. Hodges RE, Minich DM. Modulation of Metabolic Detoxification Pathways UsingFoods and Food-Derived Components: A Scientific Review with Clinical Application. J Nutr Metab. 2015;2015:760689. doi:10.1155/2015/760689Lin, Q., Cao, J., Du, X. et al. CYP1B1-catalyzed 4-OHE2 promotes the castrationresistance of prostate cancer stem cells by estrogen receptor α -mediated IL6activation. Cell Commun Signal 20, 31 (2022). https://doi.org/10.1186/s12964-021-00807-xRagavan N, Hewitt R, Cooper LJ, Ashton KM, Hindley AC, Nicholson CM, FullwoodNJ, Matanhelia SS, Martin FL. CYP1B1 expression in prostate is higher in theperipheral than in the transition zone. Cancer Lett. 2004 Nov 8;215(1):69-78. doi:10.1016/j.canlet.2004.06.051. PMID: 15374634. Romilly E. Hodges, Deanna M. Minich, "Modulation of Metabolic DetoxificationPathways Using Foods and Food-Derived Components: A Scientific Review withClinical Application",Journal of Nutrition and Metabolism, vol. 2015, ArticleID 760689, 23 pages, 2015. https://doi.org/10.1155/2015/760689Yager JD. Mechanisms of estrogen carcinogenesis: The role of E2/E1–quinonemetabolites suggests new approaches to preventive intervention – AReview. Steroids. 2015;99:56-60. doi:10.1016/j.steroids.2014.08.006Yao HT, Hsu YR, Lii CK, Lin AH, Chang KH, Yang HT. Effect of commercially availablegreen and black tea beverages on drug-metabolizing enzymes and oxidative stressin Wistar rats. Food Chem Toxicol. 2014;70:120-127. doi:10.1016/j.fct.2014.04.043
以上图片来自网络,本文旨在分享学习,如有侵权,请联系删除,谢谢!






