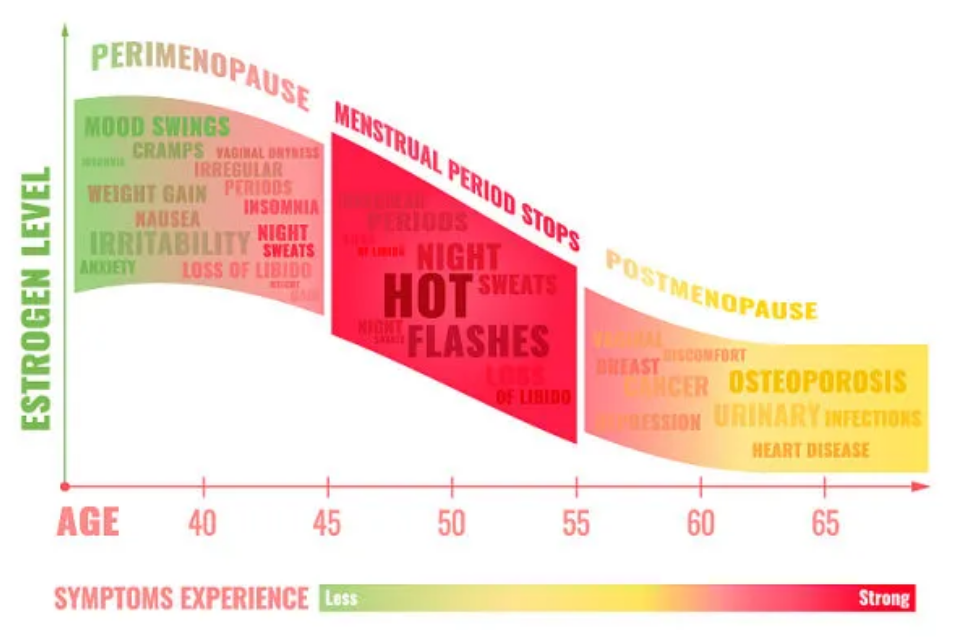
健康资讯

更多请关注微信公众号“CBHRT更年期管理”
无论原因如何,在达到自然绝经的中位年龄之前经历更年期和雌激素缺乏的女性发病和死亡的风险会增加。对于这些女性,应考虑雌激素治疗,但可能无法消除所有不良后果。
自发性卵巢早衰(POF)或提前更年期
卵巢早衰 (POF),现在也称为原发性卵巢功能不全或原发性卵巢功能障碍 ,是一种40岁以下女性闭经、性类固醇水平低和促性腺激素水平升高的综合征。POF最常见的是特发性,但也可能由自身免疫性疾病、遗传原因、感染或炎症、酶缺乏或代谢综合征引起。据报道,在40岁以下女性中,POF影响约1%,在40-45岁女性中,自发性绝经影响约5%。
已发现近一半受影响的女性POF与间歇性卵巢功能有关。虽然卵巢功能自发或诱导恢复是可能的,但与中位年龄左右自发绝经的女性相比,大多数患有POF的女性会经历更长时间的持续性类固醇缺乏。因此,在评估长期健康结果时,POF和过早自发绝经的其他原因通常被分类在一起。
诱发过早绝经或提前绝经
诱发绝经可能是由绝经前双侧卵巢切除术或包括化疗和放疗在内的癌症治疗引起的。由于儿童、青少年和育龄妇女癌症治疗的成功率不断提高,这些原因导致的过早绝经现象随着时间的推移而增加。同样,子宫切除术时预防性双侧卵巢切除术的实践也随着时间的推移而增加。然而,关于诱发绝经后的长期风险和不良健康结果的证据正在开始积累。
1.癌症治疗后诱发更年期
梅奥诊所卵巢切除术和衰老队列研究涉及4,780名女性的人群样本,报告显示45岁之前接受预防性双侧卵巢切除术的女性全因死亡率增加。死亡率增加主要见于手术后至45岁未服用雌激素的女性(HR1.93,95% CI 1.25-2.96)。45岁之前接受双侧卵巢切除术且不服用雌激素的女性心血管死亡率也会增加。
梅奥诊所卵巢切除术队列研究(Mayo Clinic Cohort Study of Oophorection and Aging)调查了双侧卵巢切除术时,双侧卵巢切除术的影响随着年龄的增长而增加。使用风险比和95%置信区间表示风险。x轴上的年龄层与认知障碍或痴呆和帕金森病的总体死亡率和心血管死亡率略有不同。



1. North American Menopause Society. Menopause Practice: A Clinician's Guide. 3rd ed. Cleveland, OH: North American Menopause Society; 2007. [Google Scholar]
2. Rocca WA, Shuster LT, Grossardt BR, Maraganore DM, Gostout BS, Geda YE, et al. Long-term effects of bilateral oophorectomy on brain aging: unanswered questions from the Mayo Clinic Cohort Study of Oophorectomy and Aging. Womens Health (Lond Engl) 2009;5:39–48. [PMC free article] [PubMed] [Google Scholar]
3. Nelson LM. Clinical practice. Primary ovarian insufficiency. N Engl J Med. 2009;360:606–614. [PMC free article] [PubMed] [Google Scholar]
4. Panay N, Kalu E. Management of premature ovarian failure. Best Pract Res Clin Obstet Gynaecol. 2009;23:129–140. [PubMed] [Google Scholar]
5. Santoro N. Mechanisms of premature ovarian failure. Ann Endocrinol (Paris) 2003;64:87–92. [PubMed] [Google Scholar]
6. Coulam CB, Adamson SC, Annegers JF. Incidence of premature ovarian failure. Obstet Gynecol. 1986;67:604–606. [PubMed] [Google Scholar]
7. Luborsky JL, Meyer P, Sowers MF, Gold EB, Santoro N. Premature menopause in a multi-ethnic population study of the menopause transition. Hum Reprod. 2003;18:199–206. [PubMed] [Google Scholar]
8. Gallagher JC. Effect of early menopause on bone mineral density and fractures. Menopause. 2007;14:567–571. [PubMed] [Google Scholar]
9. Kalantaridou SN, Naka KK, Papanikolaou E, Kazakos N, Kravariti M, Calis KA, et al. Impaired endothelial function in young women with premature ovarian failure: normalization with hormone therapy. J Clin Endocrinol Metab. 2004;89:3907–3913. [PubMed] [Google Scholar]
10. Atsma F, Bartelink ML, Grobbee DE, van der Schouw YT. Postmenopausal status and early menopause as independent risk factors for cardiovascular disease: a meta-analysis. Menopause. 2006;13:265–279. [PubMed] [Google Scholar]
11. NAMS Continuing Medical Education Activity. Menopause. 2007;14:555. [Google Scholar]
12. Jacobsen BK, Knutsen SF, Fraser GE. Age at natural menopause and total mortality and mortality from ischemic heart disease: the Adventist Health Study. J Clin Epidemiol. 1999;52:303–307. [PubMed] [Google Scholar]
13. de Kleijn MJ, van der Schouw YT, Verbeek AL, Peeters PH, Banga JD, van der Graaf Y. Endogenous estrogen exposure and cardiovascular mortality risk in postmenopausal women. Am J Epidemiol. 2002;155:339–345. [PubMed] [Google Scholar]
14. Mondul AM, Rodriguez C, Jacobs EJ, Calle EE. Age at natural menopause and cause-specific mortality. Am J Epidemiol. 2005;162:1089–1097. [PubMed] [Google Scholar]
15. Cooper GS, Sandler DP. Age at natural menopause and mortality. Ann Epidemiol. 1998;8:229–235. [PubMed] [Google Scholar]
16. Jacobsen BK, Heuch I, Kvale G. Age at natural menopause and all-cause mortality: a 37-year follow-up of 19,731 Norwegian women. Am J Epidemiol. 2003;157:923–929. [PubMed] [Google Scholar]
17. van der Stege JG, Groen H, van Zadelhoff SJ, Lambalk CB, Braat DD, van Kasteren YM, et al. Decreased androgen concentrations and diminished general and sexual well-being in women with premature ovarian failure. Menopause. 2008;15:23–31. [PubMed] [Google Scholar]
18. Hoek A, Schoemaker J, Drexhage HA. Premature ovarian failure and ovarian autoimmunity. Endocr Rev. 1997;18:107–134. [PubMed] [Google Scholar]
19. Keshavarz H, Hillis SD, Kieke BA, Marchbanks PA. Surveillance Summaries, July 12, 2002. Vol. 51. MMWR; 2002. Hysterectomy Surveillance — United States, 1994–1999; pp. 1–8. [Google Scholar]
20. Sklar C. Maintenance of ovarian function and risk of premature menopause related to cancer treatment. J Natl Cancer Inst Monogr. 2005:25–27. [PubMed] [Google Scholar]
21. Green DM, Sklar CA, Boice JD, Jr, Mulvihill JJ, Whitton JA, Stovall M, et al. Ovarian failure and reproductive outcomes after childhood cancer treatment: results from the Childhood Cancer Survivor Study. J Clin Oncol. 2009;27:2374–2381. [PMC free article] [PubMed] [Google Scholar]
22. Chen WY, Manson JE. Premature ovarian failure in cancer survivors: new insights, looming concerns. J Natl Cancer Inst. 2006;98:880–881. [PubMed] [Google Scholar]
23. Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009 [PubMed] [Google Scholar]
24. Minton SE, Munster PN. Chemotherapy-induced amenorrhea and fertility in women undergoing adjuvant treatment for breast cancer. Cancer Control. 2002;9:466–472. [PubMed] [Google Scholar]
25. Walshe JM, Denduluri N, Swain SM. Amenorrhea in premenopausal women after adjuvant chemotherapy for breast cancer. J Clin Oncol. 2006;24:5769–5779. [PubMed] [Google Scholar]
26. Ganz PA. Breast cancer, menopause, and long-term survivorship: critical issues for the 21st century. Am J Med. 2005;118:136–141. [PubMed] [Google Scholar]
27. Buijs C, de Vries EG, Mourits MJ, Willemse PH. The influence of endocrine treatments for breast cancer on health-related quality of life. Cancer Treat Rev. 2008;34:640–655. [PubMed] [Google Scholar]
28. Rocca WA, Grossardt BR, de Andrade M, Malkasian GD, Melton LJ., 3rd Survival patterns after oophorectomy in premenopausal women: a population-based cohort study. Lancet Oncol. 2006;7:821–828. [PubMed] [Google Scholar]
29. Rivera CM, Grossardt BR, Rhodes DJ, Brown RD, Jr, Roger VL, Melton LJ, 3rd, et al. Increased cardiovascular mortality after early bilateral oophorectomy. Menopause. 2009;16:15–23. [PMC free article] [PubMed] [Google Scholar]
30. Lokkegaard E, Jovanovic Z, Heitmann BL, Keiding N, Ottesen B, Pedersen AT. The association between early menopause and risk of ischaemic heart disease: influence of hormone therapy. Maturitas. 2006;53:226–233. [PubMed] [Google Scholar]
31. Parker WH, Broder MS, Chang E, Feskanich D, Farquhar C, Liu Z, et al. Ovarian conservation at the time of hysterectomy and long-term health outcomes in the Nurses' Health Study. Obstet Gynecol. 2009;113:1027–1037. [PMC free article] [PubMed] [Google Scholar]
32. Nappi RE, Sinforiani E, Mauri M, Bono G, Polatti F, Nappi G. Memory functioning at menopause: impact of age in ovariectomized women. Gynecol Obstet Invest. 1999;47:29–36. [PubMed] [Google Scholar]
33. Farrag AK, Khedr EM, Abdel-Aleem H, Rageh TA. Effect of surgical menopause on cognitive functions. Dement Geriatr Cogn Disord. 2002;13:193–198. [PubMed] [Google Scholar]
34. Sherwin BB. Estrogen and/or androgen replacement therapy and cognitive functioning in surgically menopausal women. Psychoneuroendocrinology. 1988;13:345–357. [PubMed] [Google Scholar]
35. Phillips SM, Sherwin BB. Effects of estrogen on memory function in surgically menopausal women. Psychoneuroendocrinology. 1992;17:485–495. [PubMed] [Google Scholar]
36. Kritz-Silverstein D, Barrett-Connor E. Hysterectomy, oophorectomy, and cognitive function in older women. J Am Geriatr Soc. 2002;50:55–61. [PubMed] [Google Scholar]
37. Kok HS, Kuh D, Cooper R, van der Schouw YT, Grobbee DE, Wadsworth ME, et al. Cognitive function across the life course and the menopausal transition in a British birth cohort. Menopause. 2006;13:19–27. [PubMed] [Google Scholar]
38. Nathorst-Boos J, von Schoultz B, Carlstrom K. Elective ovarian removal and estrogen replacement therapy--effects on sexual life, psychological well-being and androgen status. J Psychosom Obstet Gynaecol. 1993;14:283–293. [PubMed] [Google Scholar]
39. Aziz A, Bergquist C, Nordholm L, Moller A, Silfverstolpe G. Prophylactic oophorectomy at elective hysterectomy. Effects on psychological well-being at 1-year follow-up and its correlations to sexuality. Maturitas. 2005;51:349–357. [PubMed] [Google Scholar]
40. Madalinska JB, van Beurden M, Bleiker EM, Valdimarsdottir HB, Hollenstein J, Massuger LF, et al. The impact of hormone replacement therapy on menopausal symptoms in younger high-risk women after prophylactic salpingo-oophorectomy. J Clin Oncol. 2006;24:3576–3582. [PubMed] [Google Scholar]
41. Fang CY, Cherry C, Devarajan K, Li T, Malick J, Daly MB. A prospective study of quality of life among women undergoing risk-reducing salpingo-oophorectomy versus gynecologic screening for ovarian cancer. Gynecol Oncol. 2009;112:594–600. [PMC free article] [PubMed] [Google Scholar]
42. Michelsen TM, Dorum A, Dahl AA. A controlled study of mental distress and somatic complaints after risk-reducing salpingo-oophorectomy in women at risk for hereditary breast ovarian cancer. Gynecol Oncol. 2009;113:128–133. [PubMed] [Google Scholar]
43. Dennerstein L, Koochaki P, Barton I, Graziottin A. Hypoactive sexual desire disorder in menopausal women: a survey of Western European women. J Sex Med. 2006;3:212–222. [PubMed] [Google Scholar]
44. Melton LJ, 3rd, Khosla S, Malkasian GD, Achenbach SJ, Oberg AL, Riggs BL. Fracture risk after bilateral oophorectomy in elderly women. J Bone Miner Res. 2003;18:900–905. [PubMed] [Google Scholar]
45. Lindsay R, Hart DM, Forrest C, Baird C. Prevention of spinal osteoporosis in oophorectomised women. Lancet. 1980;2:1151–1154. [PubMed] [Google Scholar]
46. Snowdon DA, Kane RL, Beeson WL, Burke GL, Sprafka JM, Potter J, et al. Is early natural menopause a biologic marker of health and aging? Am J Public Health. 1989;79:709–714. [PMC free article] [PubMed] [Google Scholar]
47. Fogle RH, Stanczyk FZ, Zhang X, Paulson RJ. Ovarian androgen production in postmenopausal women. J Clin Endocrinol Metab. 2007;92:3040–3043. [PubMed] [Google Scholar]
48. Davison SL, Bell R, Donath S, Montalto JG, Davis SR. Androgen levels in adult females: changes with age, menopause, and oophorectomy. J Clin Endocrinol Metab. 2005;90:3847–3853. [PubMed] [Google Scholar]
49. Kalantaridou SN, Nelson LM. Premature ovarian failure is not premature menopause. Ann N Y Acad Sci. 2000;900:393–402. [PubMed] [Google Scholar]
50. Santoro N. Research on the mechanisms of premature ovarian failure. J Soc Gynecol Investig. 2001;8:S10–S12. [PubMed] [Google Scholar]
51. Utian WH, Archer DF, Bachmann GA, Gallagher C, Grodstein F, Heiman JR, et al. Estrogen and progestogen use in postmenopausal women: July 2008 position statement of The North American Menopause Society. Menopause. 2008;15:584–602. [PMC free article] [PubMed] [Google Scholar]
52. Pitkin J, Rees MC, Gray S, Lumsden MA, Marsden J, Stevenson JC, et al. Management of premature menopause. Menopause Int. 2007;13:44–45. [PubMed] [Google Scholar]
53. Board of the International Menopause S. Pines A, Sturdee DW, Birkhauser MH, Schneider HP, Gambacciani M, et al. IMS updated recommendations on postmenopausal hormone therapy. Climacteric. 2007;10:181–194. [PubMed] [Google Scholar]
54. Rebbeck TR, Kauff ND, Domchek SM. Meta-analysis of risk reduction estimates associated with risk-reducing salpingo-oophorectomy in BRCA1 or BRCA2 mutation carriers. J Natl Cancer Inst. 2009;101:80–87. [PMC free article] [PubMed] [Google Scholar]